Masson Editeur Paris, 1992.

- Dictionnaire de toxicologie clinique
La toxicologie est une discipline en pleine expansion. Si de nombreux composés sont répertoriés et leurs effets connus depuis longtemps, d’autres, nouveaux ou inédits, arrivent sans cesse sur le marché pour des usages très variés et qui se diversifient constamment.
Parmi ces produits, il en est qui sont peu ou atoxiques, mais d’autres par contre, peuvent être responsables d’intoxications graves. C’est au cours de leur production ou leur utilisation, le plus souvent lorsqu’il y a défaillance des mesures préventives, qu’elles surviennent.
Cet ouvrage, qui constitue un répertoire pratique des produits toxiques, rappelle en préliminaire les données générales de la toxicologie et l’importance de ces substances sur le plan écologique car, sans être toujours toxiques à l’échelle individuelle, elles peuvent cependant constituer, dans certains cas, une menace pour l’environnement. Il décrit ensuite le mode s’action de chaque toxique ainsi que les éléments du diagnostic et le traitement des intoxications chroniques ou aiguës. Une attention particulière est portée aux produits phytosanitaires en raison de l’importance de cette famille.
Les toxicologues, les pharmacologues, les biologistes, les chercheurs, les médecins, les équipes d’urgence, les SAMU, les secouristes, les industriels, tous ceux qui sont confrontés aux délicats problèmes de la toxicologie moderne, apprécieront les définitions précises, l’apport des données scientifiques les plus récentes et la présentation alphabétique de ce dictionnaire.
PREFACE
NOMENCLATURE
En 1957 à Paris, une commission a décidé de la façon dont les produits chimiques seraient nominés : symboliquement en spirale débutant en haut à gauche et avançant de l’extérieur vers l’intérieur dans le sens des aiguilles d’une montre.
En fait, lorsque l’utilisateur du produit veut les désigner de façon urgente, il est des mots dont la sémantique est douteuse mais la mémorisation plus aisée : ce sont les Dénominations Communes Internationales ou DCI. En pharmacologie elles sont éditées tous les deux ans par la Société Suisse de Pharmacie. A une même DCI, suivant le fabricant, correspondent les noms de spécialités ; c’est l’Index Nominum. L’Index Merk édité moins souvent regroupe les DCI pharmacologiques, celles des pesticides et des produits industriels.
Mais ces index ont des limites :
1) La substance active d’une spécialité n’est pas toujours la plus toxique. Les nécessités industrielles d’une préparation amènent le fabricant à ajouter des conservateurs, antioxydants, étuis, gélules, liquides. Ces additifs ne doivent pas être passés sous silence ; les cyclamates sont sucrés mais cancérigènes, la tartrazine est hépatotoxique par hypersensibilité immunologique.
2) Ils sont muets lorsqu’une spécialité contient plusieurs DCI, or les mélanges sont nombreux et l’interaction des produits et de leurs additifs échappe parfois aux tentatives de généralisation arithmétique parues en librairie.
3) La toxicité, pour l’homme, des spécialités nouvelles est mal connue : elles jouissent donc de la faveur de la mode. Les communications des centres de vigilance sont trop ignorées.
4) Les produits domestiques, du fait de l’absence en Europe d’une surveillance efficace sont, alors que le nom de la spécialité ne change pas – importance du marché oblige – modifiés dans leur composition.
Des fabrications peuvent être déléguées à des irresponsables dans de petites usines, sans contrôle à la sortie, ou à des pays sans couverture sociale avec copies et malfaçons.
Ailleurs, interdits en Europe, des stocks sont vendus sans scrupule dans des pays mal informés.
5) D’origine animale ou végétale, bien des toxiques sont difficilement identifiables car les usagers n’ont pas conservé le souvenir exact de l’animal ou du végétal en cause.
Quant aux identificateurs, ils n’ont pas souvent les moyens d’être précis : aussi au moindre doute, consultation médicale, prise de sang pour creening des toxiques et mise en observation.
6) Les xénobiotiques d’usage agricole : insecticides antivertébrés, hélécides, fongicides ou herbicides, pour ne citer que les principales classes, ont des DCI comme les médicaments, et des noms de spécialités suivant les pays. La recherche exacerbée de rendements agricoles, la formation variable des vendeurs et des utilisateurs … exposent à un usage incontrôlé et à une fréquente destruction des emballages descriptifs de ces produits et de leurs dangers.
7) Les produits industriels sont, les éléments mis à part, classés d’après leur fonction chimique dans les livres de toxicologie. Ceci expose au mélange dans une même classe de toxiques très dangereux comme le fluorochlorométhane (fréon R40) et de produits atoxiques comme le dichlorofluorométhane (fréon R12). Encore peut-on signaler que 25 millions de m3 de R12 utilisé comme propulseur ou réfrigérant, ont détruit en partie la ceinture de Van Allen qui protège la terre des rayons U.V. les plus agressifs.
Par ailleurs la manipulation industrielle de nombreuses substances expose à des risques toxiques. Deux exemples :
- plomb : le nettoyage des concasseurs utilise le dinitrophénol : risque d’hyperthermie ;
- aluminium : lors de son raffinage électrique, il apparaît au niveau de l’anode des hydrocarbures cancérigènes.
En conclusion, je veux faire remarquer que sont complémentaires - en prenant les isocyanates par exemple - :
- la dénomination triviale (isocyanates),
- leur usage, ce sont des résines polymérisables qui servent de matrices pour la composition des journaux,
- leur nom de spécialité : DICRYL°, NILOPRINT°,
- la nature des additifs utilisés lors de leur manipulation :
• polyène diisocyanate de toluène,
• polythiol : pentaérythrol + acide mercaptothionique polymérisé,
- la connaissance de leur toxicité :
• irritation respiratoire et cutanée extrême due au premier additif,
• sensibilisation à long terme due au second,
- le contrôle de l’atmosphère autour des travailleurs :
• légalement proposé aux U.S. inférieur à 0,14 ppm
• proposé à 0,004 au législateur,
- des mesures de protection des travailleurs et des sauveteurs contre les dangers d’incendie ou d’intoxication par ces produits qui doivent également être connus par les utilisateurs.
CHIMIE ANALYTIQUE : PROGRES ET LIMITES
Rien n’est aussi satisfaisant en apparence, que le travail au laboratoire, en dehors de l’agitation du monde, face au déroulement tranquille d’un dosage analytique. Cependant…
Les chimistes utilisent des appareils plus complexes et plus rapides, souvent coordonnés à des mémoires. De bonnes communications par écran avec impression papier sont chaque année moins coûteuses.
On pourrait multiplier les exemples, presque toutes les classes de substances sont identifiables par screening infrarouge à haute définition, puis spectrographie de masse. Les éléments sont dosables grâce à l’appareil à radio-isotopes Perkin Elmer. On se heurte alors à deux problèmes :
- Ces machines sont très coûteuses, 1 à 5 millions pour un spectrographe de masse à mémoire informatique. Plusieurs centaines de milliers de francs pour l’appareil Perkin Elmer.
- Il est surtout très vain d’annoncer des prix de machines qui ne comprennent ni leur maintenance ni la formation et la qualité des utilisateurs.
Le dosage des médicaments et celui des autres toxiques ne sont pas remboursés par la sécurité sociale, ceci explique la démotivation des divers acteurs qui, en France, prélèvent, transportent, stockent, analysent, transmettent, interprètent, accumulent les données, les publient et imaginent l’évolution souhaitable de la chimie analytique.
Enfin, la chimie n’est pas la panacée, soit car le taux des toxiques dans les liquides prélevables ne reflète pas les dangers de l’intoxication, ce qui est fréquent, soit car la modification thermodynamique des substances entraîne leur transformation en polymères, peut-être dangereux lors d’une exposition prolongée – mais non identifiables.
C’est le cas des polymérisations d’hydrocarbures benzéniques lors du contact prolongé avec les huiles à base minérale (anthracène, phénanthracène, phosphate de tricrésyl, chlorophénate de sodium).
METABOLISME DES TOXIQUES
1) Absorption, distribution, excrétion des toxiques
L’absorption respiratoire, cutanée et/ou digestive du toxique dépend de ses propriétés physico-chimiques : liposolubilité, ionisation, masse moléculaire, et des propriétés des membranes traversées par le toxique – structure lipoprotidique, hydrophilie -. Les forces agissant sur le mouvement transmembranaire des toxiques sont : la diffusion, la traversée des canaux aqueux, le transport actif grâce à la liaison à une substance porteuse :
- aliments,
- mécanisme biologique : cycle entérohépatique, concentration osseuse,
- porteur inerte vers l’appareil respiratoire (aérosol, brouillard, poussières),
- pénétration cutanée facilitée par l’émulsion dans un solvant
La distribution des toxiques ne peut être schématisée qu’en faisant appel à un certain nombre de concepts mathématiques :
- volume apparent de distribution qui est le volume dans lequel la quantité totale du toxique est uniformément répartie dans le corps, rapportée à sa concentration sanguine. On ne peut évoquer ce volume sans penser à la quantité du toxique lié à l’albumine et qui doit être prise en compte,
- la modification de la distribution par les barrières membranaires,
- la distribution dans les compartiments aqueux,
- la distribution et le stockage dans les graisses ;
- l’interaction entre la distribution des toxiques et les nucléides ou les cytochromes ou hémoprotéines.
Le système nerveux central est exposé aux toxiques du fait de deux particularités :
- son irrigation sanguine,
- son bain dans le liquide céphalo-rachidien.
Seule la fraction libre des toxiques peut entrer dans le SNC ; donc les toxiques liposolubles le pénètrent plus vite que les autres.
Cependant la situation pathologique dans laquelle se trouve l’intoxiqué, rend ce qui précède souvent inexact du fait de désordres respiratoires ou circulatoires pour ne citer que ces deux détresses.
Le transport placentaire des toxiques doit être cité du fait du caractère original de cet ensemble membranaire.
- Les mécanismes de transfert sont les suivants :
• diffusion passive
• diffusion facilitée du fait d’une concentration placentaire spécifique,
• transport actif,
• inhibition d’un transport actif,
• picnocytose (transport actif d’un toxique par vacuolisation membranaire),
• brèches membranaires à travers lesquelles le transport des toxiques sera d’autant plus important que la pression hydrostatique ombilicale de la mère vers le fœtus est élevée.
- Les facteurs qui influencent ces mécanismes de transfert sont les suivants :
• gradient de concentration des toxiques dans le sang placentaire,
• facteurs limitant la diffusion des toxiques (poids moléculaire, liposolubilité, ionisation),
• débit des artères ombilicales et utérines,
• liaisons protéiques des toxiques,
• pH,
• capture placentaire des différents métabolites actifs ou inertes.
- L’excrétion rénale des toxiques dépend d’un certain nombre de mécanismes très connus :
• débit sanguin rénal,
• filtration glomérulaire des toxiques de PM inférieurs à 1000,
• transport tubulaire des toxiques,
• bases et acides ont une clearance modifiable par modification du Ph sanguin.
Les principaux transferts sont souvent à double sens, limités par des seuils, des actions enzymatiques spécifiques et une transformation des molécules excrétées en corps plus hydrophiles et moins atoxiques
Les transferts hépatiques sont très variables d’une molécule à l’autre, même de structure voisine.
2) Biotransformation des toxiques
Tous les métabolites des toxiques ne sont pas moins dangereux.
La liste suivante qui survole les divers mécanismes donne pour chaque exemple une indication : + = plus toxique, - = moins toxique.
Les oxydations microsomiales principales sont au nombre de neuf :
![]() oxydation latérale alcoolisation du phénobarbital -
oxydation latérale alcoolisation du phénobarbital -
![]() hydroxylation hydroxylation de l’imipramine -
hydroxylation hydroxylation de l’imipramine -
![]() n-oxydation n-oxydation de la triméthylamine -
n-oxydation n-oxydation de la triméthylamine -
![]() sulfoxidation sulfoxidation de la chlorpromazine -
sulfoxidation sulfoxidation de la chlorpromazine -
![]() n-déalkylation n-déalkylation de l’amidopyrine +
n-déalkylation n-déalkylation de l’amidopyrine +
![]() o-déalkylation o-déalkylation de la phénétidine -
o-déalkylation o-déalkylation de la phénétidine -
![]() s-déalkylation s-déalkylation de la s-méthylpurine -
s-déalkylation s-déalkylation de la s-méthylpurine -
![]() désamination désamination de la diméthylnitrosamine +
désamination désamination de la diméthylnitrosamine +
![]() désulfuration désulfuration du parathion
désulfuration désulfuration du parathion
Oxydations non microsomiales :
![]() oxydation alcoolique oxydation de l’éthylène glycol +
oxydation alcoolique oxydation de l’éthylène glycol +
![]() aromatisation aromatisation de l’acide carboxycyclohexanique -
aromatisation aromatisation de l’acide carboxycyclohexanique -
Réduction :
![]() nitroréduction nitroréduction du chloramphénicol +
nitroréduction nitroréduction du chloramphénicol +
![]() azoréduction azoréduction du prontosyl -
azoréduction azoréduction du prontosyl -
![]() réduction alcoolique réduction de l’hydrate de chloral
réduction alcoolique réduction de l’hydrate de chloral
Hydrolyse : hydrolyse de la procaïne
La plupart des toxiques sont métabolisés par le foie dans les mitochondries ou les microsomes ; très souvent le toxique est soumis à différentes transformations enzymatiques en compétition simultanée à différentes vitesses. De plus, elles sont souvent séquentielles et suivies de conjugaison des métabolites. Les notions d’anabolismes et de catabolisme doivent être proscrites pour être réservées à la physiologie. Enfin, il n’y a pas de relation franche entre la taille d’une molécule toxique ou sa forme et son activité. Certains métabolismes microsomiaux peuvent être à l’origine d’hépatites foudroyantes ou de cancer.
MUTAGENESE ET GENETIQUE
1) Mutagénicité des éthylènes chlorés
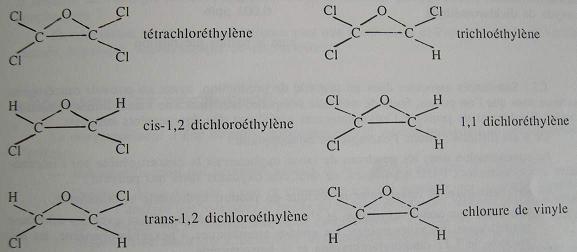
Tous les éthylènes chlorés sont transformés dans les microsomes hépatiques par les cytochromes P450 en époxydes qui peuvent, soit se transformer en aldéhydes, être hydrolysés en diols et conjugués avec le glutathion et être éliminés, soit au contraire, alkyler les macromolécules cellulaires. La mutagénicité est liée à la structure de la molécule et les corps asymétriques comme le chlorure de vinyle, le 1,1 dichloroéthylène et le trichloroéthylène sont mutagènes.
OXYRANES DES ETHYLENES CHLORES
Symétrique Asymétrique
Stable Instable
Non mutagène
Mutagène
La figure ci-dessus montre l’origine des oxyranes. C’est l’effet de la structure des éthylènes chlorés sur leur activité mutagénique, due à la réactivité chimique de leurs époxydes.
2) Toxicogénétique
Elle peut être définie comme l’étude des mutations génétiques révélées par l’action des toxiques.
Les accidents de suxaméthonium méritent dans le cadre de l’urgence, un certain développement ; ce curare provoque chez certains sujets une apnée prolongée parfois mortelle. Ceci tient au fait que sa dégradation demande l’intervention des cholinestérases sériques synthétisées par le foie. Quatre phénotypes distincts sont connus. Les sujets homozygotes pour un allèle muté sont particulièrement exposés au risque d’apnée prolongée. Le polymorphisme de ce système a provoqué de larges enquêtes génétiques de populations.
CANCEROLOGIE
Actuellement la liste des substances cancérogènes se divise en deux :
- C1 : substances auxquelles on assigne une valeur limite
- C2 : Substances pour lesquelles les conditions de l’environnement n’ont pas été suffisamment définies pour qu’e l’on puisse leur attribuer cette valeur.
C1 Valeur limite
Acrylonitrile 2 ppm
Amiante 2 à 0,2 fibres par micron3
Chlorure de vinyle 5 ppm
Chrome 0,05 mg/m3
Composés aromatiques particulaires 0,2 mg/m3
(fractions solubles dans le benzène)
Nickel 1 mg/m3
Oxyde de dichlorométhyle 0,001 ppm
ppm = parties par million
C2 : Substances associées dans un procédé de production, ayant un pouvoir cancérogène reconnu sans que l’on puisse, faute de méthode adéquate, leur fixer une valeur limite de concentration. Il convient de protéger l’environnement social par des équipements adéquats.
Or c’est difficile : citons l’exemple du benzopyrène :
Sa concentration dans les goudrons de tabac expliquerait la cancérogenèse par l’intermédiaire des cytochromes P450 hépatiques, ce sont des oxydants forts qui peuvent :
- soit détoxiquer et transformer le toxique en produit hydrophile et éliminable,
- soit avoir une action oxydative et l’on observe la cancérogenèse avec les éthylènes asymétriques, les nitrosamines, les amines aromatiques, l’hexachlorobenzène, les biphényls, le 7, 12 diméthylanthracène et le benzopyrène.
Il est bien évident que la protection des populations s’arrête souvent passée la porte de l’entreprise.
IMMUNOTOXICOLOGIE
Elle comporte deux types de réaction :
1) Cytotoxicité induite par les anticorps en présence de complément. Certaines allergies relèvent de ce mécanisme par fixation du composé sur les hématies ou les leucocytes. A ces réactions hétérogènes, on rattache celles de toxicité cellulaire exercée par les cellules K vis-à-vis de cellules cibles recouvertes d’anticorps IgG. La définition des cellules K est essentiellement négative ; les mieux connues sont les polynucléaires, les macrophages, les plaquettes, les cellules de foie fœtal et surtout les cellules lymphocytaires dépourvues des marqueurs et des propriétés des cellules B et T.
Les mécanismes de la toxicité sont complexes, ils font intervenir des anticorps IgG, le site de liaison et le fragment Fc du complément. On pense que l’anticorps sert essentiellement de pont entre la cellule et la cible. Mais ce n’est pas suffisant pour déclancher la lyse ; la cellule K doit être métaboliquement active et infestée par la substance active.
2) Hypersensibilité retardée ; elle peut être causée par un second contact avec trichlorobenzène, dinitrochlorobenzène, dinitrofluorobenzène, tartrazine…
Ces corps irritants par eux-mêmes sont très répandus dans les cosmétiques, les colorants ou de nombreux produits à usage professionnel : formol, résines synthétiques, antioxydants, térébenthines…
C’est parfois le produit de dégradation de la substance principale qui modifie la structure des protéines, par exemple en détruisant les ponts disulfures. Ce problème est compliqué par l’existence de nombreuses réactions croisées et celle de polysensibilisations.
Ainsi, les sujets sensibles à la paraphénylènediamine le sont aussi à l’aniline, à l’aminophénol, au diaminophénol, à la méthylaniline, à l’aminobenzène, sans réagir aux autres substances possédant un groupe para amine.
Il faut encore signaler que nul terrain génétique ne semble prédisposer aux allergies toxiques tandis que l’administration de médicaments immunosuppresseurs n’entraîne en règle pas la sédation de l’allergie toxique ; elle peut même la favoriser par son action inhibitrice sur les lymphocytes T.
En conclusion, les réactions allergiques sont très nombreuses et à symptomatologie variée : cutanée, hépatique, néphrologique ou respiratoire.
INFORMATION ET PERTINENCE
Le développement d’une nouvelle substance vers le marché passe par un certain nombre d’étapes :
- son identification qui demande acteurs et instruments adéquats à la recherche ;
- l’analyse de sa toxicité aiguë et chronique qui est protégée par le secret industriel. Ainsi l’analyse des mélanges d’huiles de base et de solvants réclame plusieurs années de recherche sur la mutagenèse à l’aide de microscopes électroniques, et de stockage informatique des données acquises au jour le jour.
Cette étape ayant été franchie et la toxicité reconnue comme relativement tolérable pour l’homme, une nouvelle substance ou un nouveau mélange sont admis à pénétrer sur le marché industriel à fins de fabrication, ce qui implique la surveillance des travailleurs et l’aménagement de nouveaux postes de travail avant d’être contrôlés à la sortie et diffusés.
En conclusion, la toxicologie est une science extrêmement complexe qui nécessite beaucoup de moyens, de grandes compétences et un travail très ardu. De ce fait, le nombre des écrits de qualité est limité. Pourtant, il s’agit d’une discipline qui conditionne toute notre existence et l’avenir même de notre société. Ce dictionnaire de Jean-Charles Hachet offre d’énormes avantages : définitions précises des mots, présentation de l’évolution des idées pendant la période 1980-1991, avenir de la toxicologie, toxicologie de l’environnement, qu’elle soit aérienne ou aqueuse.
Nul doute que ce nouveau « Hachet » produit par un spécialiste unanimement reconnu comme l’un des plus grands à l’heure actuelle, rendra d’éminents services à tous ceux, très nombreux, qui sont confrontés aux délicats défis de la toxicologie moderne.
Professeur Jean-Pierre FRÉJAVILLE
Toxicologie- Thérapeutique
Faculté Paris Necker
INTRODUCTION
La toxicologie est une discipline en pleine expansion. Si de nombreux composés sont repertoriés et leurs effets connus depuis longtemps, d’autres, nouveaux ou inédits, arrivent sans cesse sur le marché pour des usages très variés et qui se diversifient constamment.
Parmi ces produits, il en est qui sont peu ou atoxiques, mais d’autres par contre peuvent être responsables d’intoxications graves. C’est au cours de leur production ou lors de leur utilisation, le plus souvent lorsqu’il y a défaillance des mesures préventives, qu’elles surviennent.
Le but de notre travail est d’apporter, sous forme d’un dictionnaire pratique de toxicologie clinique, une description actuelle des éléments du diagnostic et du traitement des intoxications, ainsi que du mode d’action des produits toxiques. Nous avons porté une attention particulière aux produits phytosanitaires en raison de l’importance toujours grandissante de cette famille (nous mentionnerons les spécialités et leur composition).
Nous rappellerons dans cette introduction des données générales de toxicologie – facteurs de toxicité, mode d’action - , nous décrirons l’aspect particulier du métabolisme des produits phytosanitaires, et nous soulignerons l’importance de ces diverses substances sur le plan écologiques car celles-ci, sans toujours être très toxiques à l’echelle individuelle peuvent cependant constituer une menace pour l’environnement, dans certains cas.
DONNEES GENERALES DE TOXICOLOGIE
On distingue les intoxications aiguës, subaiguës et chroniques en fonction du temps d’exposition au toxique.
![]() Les intoxications aiguës sont provoquées par une exposition courte, une absorbtion rapide du toxique, et elles surviennent dans les minutes ou les heures qui suivent cette exposition.
Les intoxications aiguës sont provoquées par une exposition courte, une absorbtion rapide du toxique, et elles surviennent dans les minutes ou les heures qui suivent cette exposition.
![]() Les intoxication subaiguës pour lesquelles le délai d’apparition des signes cliniques est de quelques jours à quelques semaines, période pendant laquelle le sujet a été régulièrement ou fréquemment exposé au toxique.
Les intoxication subaiguës pour lesquelles le délai d’apparition des signes cliniques est de quelques jours à quelques semaines, période pendant laquelle le sujet a été régulièrement ou fréquemment exposé au toxique.
![]() Les intoxications chroniques se manifestent après une période d’exposition répétée et prolongée.
Les intoxications chroniques se manifestent après une période d’exposition répétée et prolongée.
FACTEURS DE TOXICITE
L’analyse de la toxicité d’une substance montre qu’elle dépend des conditions d’exposition et de ce que nous appelerons les récepteurs.
Plusieurs facteurs interviennent dans l’exposition à un toxique :
![]() Les propriétés du toxiques,
Les propriétés du toxiques,
![]() La concentration du toxique,
La concentration du toxique,
![]() Le mode de pénétration,
Le mode de pénétration,
![]() Le site d’action,
Le site d’action,
![]() Les facteurs environnementaux,
Les facteurs environnementaux,
![]() L’exposition antérieure à ce même toxique.
L’exposition antérieure à ce même toxique.
La réponse toxique est fonction des propriétés physico-chimiques de celui-ci. Elle dépend de sa solubilité, dans le sang et dans les tissus, de la tension de vapeurs, de la constante d’ionisation, de la réactivité chimique, du diamètre aérodynamique des particules. La quantité d’aérosol solide susceptibler de se déposer dans les voies respiratoires inférieures est davantage en relation avec ce dernier facteur qu’avec sa concentration atmosphérique. Par exemple, les particules d’oxydes métalliques les plus réactives sont celles dont la taille est inférieure à 0,5 micron ce qui leur permet de parvenir plus aisément jusqu’aux alvéoles pulmonaires.
En outre, la réponse toxique diffère selon la forme physico-chimique de contact entre une substance et l’organisme. La durée de rétention dans le tissu pulmonaire d’un hydrocarbure polycyclique par exemple, varie selon que ce dernier est inhalé seul ou absorbé à la surface de particules solides comme l’oxyde de fer. Autre exemple, celui de l’oxyde de cadmium : son inhalation sous forme de poudre grossière entraîne une coloration jaune des dents ; sous forme de fines particules, il provoque des manifestations digestives et des pertubations pulmonaires et rénales ; enfin, son inhalation sous forme de fumées, est responsable d’œdème pulmonaire.
L’intensité des effets toxiques peu varier en fonction de modifications de la structure moléculaire même minime en apparence. On peut citer l’exemple de l’isométrie de position qui sont à l’origine de la différence de toxicité existant entre les six isomères du dinitrophénol. Dans l’étude de la toxicité d’une substance chimique, on peut se limiter à celle de la formule brute mais on doit considérer toute les données en particulier sa structure spatiale.
Le risque toxique par ailleurs, peut provenir des impuretés. C’est le cas du toluène contenant du benzène, du ferrosilicium qui recèle du manganèse, du zinc où l’on retouve du manganèse et du plomb, ou bien encore, de l’antimoine qui renferme de l’arsenic et du plomb.
Plusieurs modes d’évaluation sont utilisés en toxicologie pour analyser la gravité du toxique :
![]() la dose létale 50 (DL 50) : dose qui a entraîné le décès de la moitié du lot d’animaux de laboratoire soumis au toxique étudié ;
la dose létale 50 (DL 50) : dose qui a entraîné le décès de la moitié du lot d’animaux de laboratoire soumis au toxique étudié ;
![]() la concentration létale 50 (CL 50) : dose qui a entraîné le décès de la moitié du lot d’animaux de laboratoire soumis à des toxiques sous forme de gaz ou de vapeurs ;
la concentration létale 50 (CL 50) : dose qui a entraîné le décès de la moitié du lot d’animaux de laboratoire soumis à des toxiques sous forme de gaz ou de vapeurs ;
![]() les doses ou les concentrations efficaces : ce sont celles qui provoquent un type d’effet clairement défini (irritation des voies respiratoires, narcose…), chez la moitié des animaux soumis au toxique étudié.
les doses ou les concentrations efficaces : ce sont celles qui provoquent un type d’effet clairement défini (irritation des voies respiratoires, narcose…), chez la moitié des animaux soumis au toxique étudié.
On pratique une extrapolation à partir de ces données, en veillant à garder une marge de sécurité et en définissant un facteur de correction. C’est ainsi que l’on arrive à déterminer une concentration limite acceptable par l’organisme humain.
Il faut faire remarquer que la durée du séjour en atmosphère contaminée ainsi que la vitesse d’administration du toxique influent également sur la quantité de substance toxique susceptible de parvenir à l’organe-cible.
Le mode de contamination détermine en grande partie l’importance de la dose toxique parvenant dans la circulation sytémique et gagnant l’organe-cible. Habituellement le classement par ordre de gravité croissante est le suivant : voie cutanée, digestive, pulmonaire, parentérale. Le taux d’absorption d’un toxique présente en effet des variations considérables selon le mode de contamination ; on constate par exemple que pour le plomb ce taux est de 50% en cas d’inhalation et de 5% seulement après ingestion.
Le degré d’atteinte de l’organe-cible est, lui aussi, fonction du mode de contamination. Nous prendrons ici l’exemple du mercure métal : alors que son ingestion conduit à une faible absorption et à une accumulation dans le foie et les reins, l’inhalation de vapeurs de mercure permet au toxique de franchir aisément la barrière alvéolo-capillaire et de s’accumuler de façon presque irreversible dans le cerveau.
Le site d’action d’un toxique :
![]() Le foie est très souvent un des organes-cibles des toxiques ingérés en raison de sa position par rapport aux circulations sanguines, il représente le passge obligé de toutes les molécules ayant franchi la barrière intestinale et cela même des composés liposolubles.
Le foie est très souvent un des organes-cibles des toxiques ingérés en raison de sa position par rapport aux circulations sanguines, il représente le passge obligé de toutes les molécules ayant franchi la barrière intestinale et cela même des composés liposolubles.
![]() La localisation d’un toxique dans tel ou tel organe est en grande partie fonction de ses affinités physico-chimiques. C’est le cas des solvants qui sont lipophiles et qui se fixeront électivement dans les tissus riches en lipides tels que les centres nerveux.
La localisation d’un toxique dans tel ou tel organe est en grande partie fonction de ses affinités physico-chimiques. C’est le cas des solvants qui sont lipophiles et qui se fixeront électivement dans les tissus riches en lipides tels que les centres nerveux.
Mentionnons également l’affinité chimique à l’origine de l’action particulière qu’exerce le toxique sur certains constituants cellulaires. Nous prendrons par exemple l’affinité du béryllium pour les phosphates – ce qui explique les pertubations enzymatiques induites - , et son action stimulante sur la lacticodéshydrogénase – à l’origine des manifestations hypoglycémiques propres à cette intoxication.
L’environnement, par l’intermédiaire d’un certain nombre de facteurs dits exogènes, joue également un rôle dans la toxicité d’une substance. Ceux –ci peuvent, soit altérer un composé donné qui va se décomposer en d’autres produits toxiques, soit modifier son métabolisme et donc la toxicité du produit nocif absorbé par l’organisme.
Pour le premier processus nous citerons les exemples d’une décomposition à froid des cyanures, des sulfures, des polysulfures alcalins, alcalino-terreux et métalliques en présence d’eau ou d’acide ; d’une altération à la lumière et à l’air du chloroforme ; d’une décomposition à chaud au perchloréthylène, du tétrachlorure de carbone et du trichloréthylène en phosgène ; d’une décomposition à chaud avec dégagement de fumées toxiques du pentachlorure et du trichlorure de phosphore, et du polytétrafluoréthylène.
Pour le deuxième processus nous citerons la lumière, la chaleur, l’humidité, le bruit comme pouvant être à l’origine de modifications de la toxicité d’une substance. Citons ici l’exemple des réactions photo-toxiques cutanées – une substance sur ou dans les téguments est excitée par la lumière – ou celui du dinitrophénol beaucoup plus dangereux en été et pour les ouvriers en transpiration.
Nous mentionnerons aussi dans ce paragraphe, le cas d’une exposition simultanée à plusieurs toxiques. Dans cette situation il se produit des interférences entre les métabolismes des différentes substances toxiques ce qui peut modifier leur toxicité.
Il peut s’agir d’une simple addition des effets, d’une synergie où l’effet d’ensemble est supérieur à la somme des effets toxiques de chaque composé pris isolément, d’un antagonisme où la réaction de l’ensemble est inférieure à la somme des réactions partielles.
Pour illustrer l’effet synergique on évoquera l’augmentation de sensibilité de l’organisme aux effets de toxiques par la prise de boissons alcoolisées. Ce phénomène survient relativement fréquemment en particulier lors d’une intoxication par des solvants chlorés (trichloréthylène) ou des poisons méthémoglobinisants. Il résulte dans ces deux cas d’une sollicitation et de l’interférence de processus métaboliques identiques.
Quant à l’administration répétée d’une même substance, elle peut donner lieu soit à une dépendance (cas des stupéfiants) soit à une tolérance acquise progressivement (cas de l’éthanal ou de l’arsenic par exemple), soit enfin, à une sensibilisation ou intolérance dite acquise ; la combinaison du toxique avec des protéines tissulaires ou circulantes se traduisant par la formation d’un complexe antigénique à propriétés sensibilisantes. En cas de nouveau contact avec ce toxique celui-ci se comporte en réactogène et entraîne des accidents locaux (dermites) ou généraux.
Une substance toxique donnée provoque des effets qui dépendent de l’organisme récepteur ; ainsi, les différentes espèces animales ont une sensibilité et une réaction variables selon les espèces pour un même toxique. Les variations de sensibilité selon les espèces animales s’expliquent principalement par des différences au niveau de la pénétration, de la distribution et du métabolisme des toxiques ; accessoirement par des différences de sensibilité de l’organe, de la cellule ou de la molécule-cible.
Chez l’homme également il existe des différences de sensibilité à un même toxique. Elles sont liées à :
![]() l’ethnie : des déficiences enzymatiques héréditaires expliquent ce facteur ;
l’ethnie : des déficiences enzymatiques héréditaires expliquent ce facteur ;
![]() le sexe : la dépendance hormonale de certains métabolismes peut modifier l’intensité d’une réponse toxique ;
le sexe : la dépendance hormonale de certains métabolismes peut modifier l’intensité d’une réponse toxique ;
![]() le poids : on peut établir une relation entre la surface corporelle et la dose toxique. Il faut souligner ici le rôle et l’importance du stock de cellules graisseuses surtout lorsqu’il s’agit d’un toxique liposoluble ;
le poids : on peut établir une relation entre la surface corporelle et la dose toxique. Il faut souligner ici le rôle et l’importance du stock de cellules graisseuses surtout lorsqu’il s’agit d’un toxique liposoluble ;
![]() l’âge : les activités métaboliques varient selon l’âge de l’individu, les sujets jeunes étant plus affectés par les poisons cérébraux et les personnes âgées plus sensibles aux poisons pulmonaires et hépatiques ;
l’âge : les activités métaboliques varient selon l’âge de l’individu, les sujets jeunes étant plus affectés par les poisons cérébraux et les personnes âgées plus sensibles aux poisons pulmonaires et hépatiques ;
![]() les variations individuelles : elles sont imputées à des variations du patrimoine génétique individuel ; pour expliquer les cas où une réponse toxique est exacerbée, on envisage l’hypothèse d’une déficience génétique ;
les variations individuelles : elles sont imputées à des variations du patrimoine génétique individuel ; pour expliquer les cas où une réponse toxique est exacerbée, on envisage l’hypothèse d’une déficience génétique ;
![]() l’état physiologique ou physiopathologique : l’hyperventilation provoquée par l’effort musculaire favorise l’intoxication par inhalation, l’hypersudation est accompagnée d’une vasodilatation qui facilite un passage transcutané, les lésions tégumentaires également.
l’état physiologique ou physiopathologique : l’hyperventilation provoquée par l’effort musculaire favorise l’intoxication par inhalation, l’hypersudation est accompagnée d’une vasodilatation qui facilite un passage transcutané, les lésions tégumentaires également.
On peut citer d’autres exemples : l’absorption digestive s’effectue plus rapidement si le sujet est à jeun, par contre la réplétion la ralentit ; la grossesse et l’allaitement rendent la femme plus vulnérable aux effets d’un toxique. Enfin la résistance de l’organisme diminue et le sujet est fragilisé soit lors d’états pathologiques – insuffisance hépatique, insuffisance rénale, dysfonctionnement endocrinien, alcoolisme – soit lorsqu’il vient de subir une agression – surmenage, traumanisme psycho-affectif, agression physique - . Quelle que soit la nature de l’agression, elle entraîne une hypersécrétion de catécholamines responsable d’une altération des capacités fonctionnelles hépatiques et rénales.
MODALITE D’ACTION DES TOXIQUES
L’agression de l’organisme par un toxique peut être directe et spécifique ou provoquer selon un mécanisme aspécifique, des réactions que l’on retrouvera face à n’importe quel type d’agression. Dans certains cas on observe une combinaison de ces deux mécanismes : la substance toxique peut induire dans un premier temps des troubles spécifiques et dans un deuxième temps des réactions aspécifiques, pour d’autres poisons la réponse à l’agression est spécifique lors d’une intoxication chronique et aspécifique lorsqu’elle est aiguë.
L’agression spécifique est à l’origine de lésions organiques et de troubles fonctionnels. La nature de ces lésions dépend des propriétés du toxique, de son mode de pénétration et d’élémination, et de l’importance de la dose absorbée par l’organisme.
On peut donner comme exemple celui de la néphrite épithéliale provoquée par l’intoxication mercurielle aiguë et celui de l’hémolyse massive qui caractérise l’intoxication par l’hydrogène arsénié.
Les troubles fonctionnels sont divers et déterminés par le mécanisme d’action du toxique qui peut-être :
![]() enzymatique, c’est le cas des insecticides organo-phosphorés inhibiteurs des cholinestérases (Parathion).
enzymatique, c’est le cas des insecticides organo-phosphorés inhibiteurs des cholinestérases (Parathion).
Un autre exemple est fourni par l’acide cyanhydrique qui, en bloquant l’action oxydante du fer, entraîne une anoxie cellulaire ;
![]() physico-chimique, on nommera ici les substances méthémoglobinisantes et l’oxyde de carbone. Dans ces cas, l’hémoglobine ne peut assurer sa fonction de vecteur d’oxygène normalement. Les signes fonctionnels d’intoxication apparaissent lorsque 30 à 40% de l’hémoglobine ont été oxydés.
physico-chimique, on nommera ici les substances méthémoglobinisantes et l’oxyde de carbone. Dans ces cas, l’hémoglobine ne peut assurer sa fonction de vecteur d’oxygène normalement. Les signes fonctionnels d’intoxication apparaissent lorsque 30 à 40% de l’hémoglobine ont été oxydés.
Pour un grand nombre d’agressions toxiques aiguës, on observe uniquement des réponses aspécifiques cliniques ou fonctionnelles qui présentent souvent beaucoup de symptômes communs. Les lésions histologiques constatées sont identiques à celles décrites en cas de choc traumatique ou infectieux aigu : congestion diapédétique diffuse s’accompagnant d’œdème intersticiel, rupture des capillaires, gonflement de l’endothélium vasculaire, lésions cellulaires d’origine métabolique.
Différentes études sur les réactions – complexes – au choc toxique ont mis en évidence une composante neuro-végétative et une action endocrinienne (Selye a montré l’existence d’une sécrétion de cortisone accrue par la cortiso-surrénale, sous l’influence de l’ACTH hypophysaire).
Enfin, comme nous l’avons déjà évoqué plus haut, il n’est pas toujours possible de définir les limites et les corrélations entre les perturbations aspécifiques de la réaction post-agression et les troubles induits directement par l’action du toxique. Dans un certain nombre de cas, les désordres spécifiques sont suivis d’une réaction aspécifique car les deux modalités imbriquées interviennent.
EXEMPLE DE METABOLISMES TOXIQUES : LE CAS DES PESTICIDES
Les pesticides sont presque tous dangereux pour l’homme car ils interfèrent avec le métabolisme cellulaire.
Toutes les protéines sont constituées à partir de 20 acides aminés liés par leur covalence, et elles ont des fonctions très diverses : protéines de transport, protéines contraciles, protéines structurales, protéines de défense, protéines régulatrices (hormones), protéines enzymes (environ 2000).
Les enzymes sont classés par les réactions qui catalysent :
![]() oxydoréductases : transfert d’électrons,
oxydoréductases : transfert d’électrons,
![]() transférases : transfert de groupements (exemple – CH3),
transférases : transfert de groupements (exemple – CH3),
![]() hydrolases : transfert de groupements fonctionnels vers l’eau,
hydrolases : transfert de groupements fonctionnels vers l’eau,
![]() lyases : addition de groupements à doubles liaisons,
lyases : addition de groupements à doubles liaisons,
![]() isomérases : foramtion d’isomères,
isomérases : foramtion d’isomères,
![]() ligases : formation de liaisons C-C, C-S, C-O, C-N, par réaction de condensation, couplées au clivage de l’ATP.
ligases : formation de liaisons C-C, C-S, C-O, C-N, par réaction de condensation, couplées au clivage de l’ATP.
Exemple : ATP Glucose ---------------------ADP Glucose -6-Phosphate
enzyme = hexokinase
ATP = Adényl Tri Phosphate
Les enzymes peuvent être empoisonnés par des agents chimiques spécifiques inhibiteurs, réversibles ou irréversibles. Le diisopropylphosphate inhibe de façon irréversible la cholinestérase ; ce n’est pas un pesticide. Le malathion inhibe de façon réversible la cholinestérase ; c’est un pesticide.
Pénétration cellulaire des pesticides :
Les pesticides liposolubles (éthers, cétones, aldéhydes) pénètrent beaucoup plus facilement dans la cellule que les dérivés hydrosolubles (acides, bases).
Une fois à l’intérieur de la cellule, le métabolisme des pesticides entraîne leur transformation au niveau des microsomes, cette transformation peut-être :
![]() une hydroxylation aromatique ou aliphatique,
une hydroxylation aromatique ou aliphatique,
![]() une déalkylation,
une déalkylation,
![]() une désamination,
une désamination,
![]() une N-oxydation.
une N-oxydation.
Les enzymes microsomiaux peuvent métaboliser les pesticides par d’autres mécanismes que l’oxydation ou la réduction ; mais l’oxydo-réduction suffit à faire comprendre le métabolisme microsomial que l’on peut réduire à cette formule :
oxygène actif + pesticide ---------------pesticide oxydé + H2O
Les composants du système microsomial de métabolisation des pesticides sont :
1. Le cytochrome P450 hémoprotéine présente en abondance non seulement dans les mitochondries de bien des cellules de l’organisme (foie, rein).
Certaines substances, comme les détergents, détruisent l’activité métabolique du cytochrome P450 qui devient le cytochrome 420. Cette transformation est bien visible en spectrographie infrarouge.
D’autres produits augmentent la quantité de cytochrome P450 dans les microsomes hépatiques. Ce sont les inducteurs dont le plus connu est le phénobarbital.
Le cytochrome P450 se lie à certaines fonctions chimiques de la formule de certains pesticides. Cette liaison entraîne une modification de son spectre infra-rouge ; c’est le cas des fonctions acétanilide, acétone, amide, cyanure, et de divers organo-chlorés, de la nicotine et de la roténone.
2. NAPDH – cytochrome P réductase
Bien des pesticides sont métabolisés plus rapidement en présence de grandes quantités de cet enzyme qui agit surtout lors de la méthylation et de l’hydroxylation.
La signification toxicologique d’un enzyme commun au métabolisme des pesticides est considérable pour comprendre l’action des pesticides chez l’homme, pour entreprendre des thérapeutiques adaptées à la multitude des produits et pour savoir si, sur ce site métabolique, les pesticides vont avoir entre eux une action synergique, addictive ou inhibitrice.
Le transport des électrons et la phosphorilation oxydative s’effectuent dans la membrane mitochondriale interne. Dans les cellules eucaryotes presque toutes les déshydrogénations spécifiques nécessaires à l’oxydation du pyruvate et des autres carburants par le cycle de l’acide citrique, sont localisées dans le compartiment interne de la mitochondrie, la matrice.
TOXICOLOGIE ET ENVIRONNEMENT
Beaucoup de composés peuvent constituer des sources de pollution ou de déséquilibre pour l’environnement. Prenons l’exemple des pesticides. Moins ils sont biodégradables plus l’environnement est menacé. C’est le cas des insecticides organo-chlorés qui détruisent la chaîne alimentaire du plancton aux poissons, des insectes aux oiseaux et gibiers et peuvent entraîner une désertification de grandes surfaces.
Les substances de croissance introduites, augmentent ou réduisent le développement, le nombre et la taille des cellules et interfèrent avec les substances de croissance naturelles, par exemple pour diminuer le volume de paille ou pour l’éclairage des fruits.
En outre, l’usage des pesticides entraîne un clonage des cultures qui deviennent plus sensibles aux modifications du climat. C’est pourquoi l’Institut National de Recherche Agronomique développe sur l’île de Porqueroles et dans divers « laboratoires de la planète » des variétés différentes qui permettent le maintien d’une espèce dans le paysage végétal.
Il faut souligner ici l’orientation de la recherche vers des molécules moins toxiques ou moins polluantes.
Prenons un deuxième exemple, celui des troubles respiratoires favorisés par les fumées industrielles, le chauffage urbain, la circulation automobile et renforcés lors de certaines conditions climatiques : brouillard, absence de vent, smog. On peut ici citer le cas de la ville de Mexico où le taux moyen d’anhydrique sulfureux est de 204 microgrammes/m3 ; par comparaison, le taux moyen dans les villes françaises est aux environ de 50 microgrammes/m3.
REMARQUES
Les substances polluantes de l’environnement (atmosphère et eau) et toutes leurs implications sont répertoriées et leurs effets analysés.
Il nous a semblé intéressant de regrouper dans les listes les effets respiratoire, cardio-vasculaire, cutané ou cancérogène de différents composés, en complément des informations données dans la description de chaque substance (exemple : TOXIQUES HEPATIQUES, TOXIQUES CUTANES…).
C’est de façon délibérée que nous n’avons pas traité les produits médicamenteux qui représentent à eux seuls, une liste importante de composés dont la toxicité sera décrite et analysée dans un prochain ouvrage.
Nous avons inclus dans ce dictionnaire des termes représentant un usage (exemple les antirouilles, les peintures), ce qui permet de regrouper des produits de familles chimiques différentes mais dont l’utilisation est commune (avec un renvoi aux substances décrites).
Extrait de l’ouvrage relatif aux toxiques cardio-vasculaires